丹瑞中国核心产品普列威获临床试验许可
发布时间:2020-08-11来源:作者:
浏览:0 打印
字号:大中小
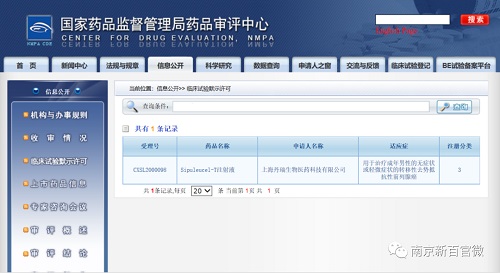
8月5日,上海丹瑞生物医药科技有限公司(以下简称“丹瑞中国”)正式获得国家药品监督管理局药品审批中心(CDE)关于同意sipuleucel-T注射液(商品名Provene,普列威)用于转移性去势抵抗性前列腺癌(mCRPC)的临床试验默示许可的公示批准。
普列威—基础信息
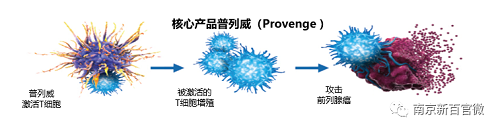
普列威是树突状细胞激活的自体混合淋巴细胞制剂,用于治疗无症状或轻微症状的mCRPC ,于2010年获得美国食品药品监督管理局(FDA)批准上市,作为全球首个细胞免疫治疗药物,开创了癌症免疫治疗的新时代。
普列威—作用原理
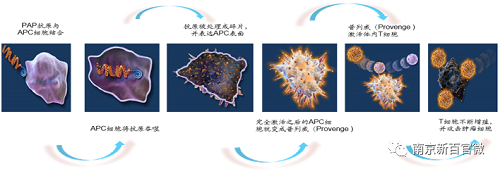
普列威作为自体细胞免疫治疗药物,需要通过白细胞单采术采集患者的免疫细胞。采集到的抗原递呈细胞(APC)在体外与前列腺酸性磷酸酶-粒细胞-巨噬细胞集落刺激因子(PAP-GM-CSF)结合,PAP-GM-CSF被APC吞噬后,表达在APC表面。成熟的APC回输到患者体内并激活患者的免疫细胞,使免疫细胞识别并杀灭前列腺癌细胞,从而治疗前列腺癌。
普列威—治疗流程
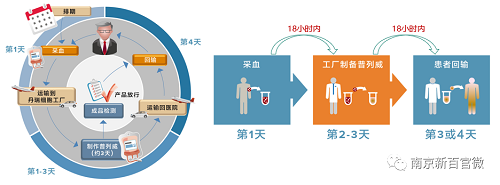
普列威治疗流程需要经过采血、运输、制备以及回输这几个步骤,每次流程需要3~4天,每两周一次,三次完成治疗。
关于丹瑞
上海丹瑞是三胞集团旗下的一家创新型生物医药公司,成立于2018年初,坐落在张江药谷核心区域。公司加速推进全球首个细胞免疫治疗药品普列威落地中国,将丹瑞美国前沿的全套免疫细胞治疗技术转移到中国,打造中国细胞免疫治疗转化平台,建立行业领先的生产和质控标准,为国内细胞免疫公司提供一站式、多维度的产业化解决方案。此次丹瑞中国获得国家药品监督管理局的临床试验许可,标志着普列威在国内申报上市的进程跨出了标志性的一步。


